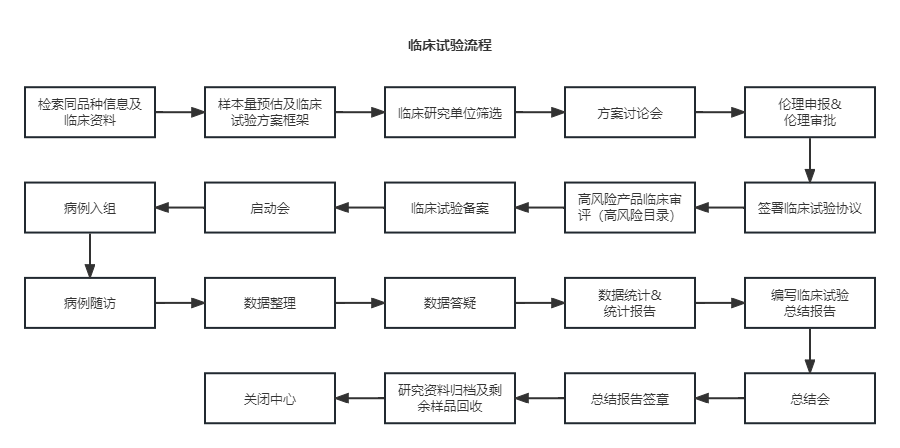
首页>>服务项目>>医疗器械临床试验服务
首页>>服务项目>>医疗器械临床试验服务临床试验设计 |
临床试验早期启动阶段 |
临床试验的开展与监察 |
数据整理与数据分析 |
临床试验总结报告 |
临床试验方案 |
项目申报与审批 |
病例入组 |
数据录入、审查与验证 |
完成临床试验总结报告 |
病例报告表(CRF) |
伦理委员会 |
文档管理 |
数据答疑 |
|
知情同意书 |
与临床试验机构签订临床试验合同 |
病例登记表 |
数据库质量控制 |
跟进总结报告的审批 |
记录表单模板 |
建立临床试验主要资料 |
完成临床试验记录 |
执行数据统计分析 |
关闭中心 |
研究者与临床研究单位的资质鉴定 |
临床试验项目管理与监察计划制定 |
常规监察访问(病例随访) |
编写数据分析报告 |
|
临床试验标准操作规程 |
临床试验项目启动会与培训 |
临床试验审计 |
|
|
研究者手册 |
|
|
|
|
方案讨论会 |
|
|
|
|